Технологии геномного редактирования
Геномное редактирование является одним из самых востребованных методов направленного изменения экспрессии генов в исследованиях по изучению роли отдельных генов и разработке новых подходов к терапии заболеваний. Методы геномного редактирования активно применяются в фундаментальных и прикладных исследованиях.
1
Как работает геномное редактирование?
Редактирование генома — это процесс нацеленного изменения генетического кода организма. Базовый принцип геномного редактирования основан на внесении разрывов в структуру ДНК.
В этом процессе участвуют специальные ферменты – нуклеазы. При этом специфичное действие нуклеаз в целевых областях генома осуществляется за счет направляющей нуклеотидной последовательности или специальных ДНК-связывающих доменов.
Редактирование может осуществляться несколькими способами. Наиболее распространённый — это внесение двухцепочечных разрывов, которые устраняются системой репарации по механизму негомологичного соединения концов или гомологичной рекомбинации. В таком случае негомологичное соединение концов обычно приводит к удалению протяженных участков или интеграции случайных фрагментов ДНК.
Подобные мутации позволяют получить «нокаут» гена, что означает полную и необратимую остановку его экспрессии в клетке. Гомологичная рекомбинация более сложный процесс, который требует наличия «матрицы» для репарации с участками, комплементарными последовательности нуклеотидов, фланкирующих сайт направленного гидролиза.
2
История развития инструментов для геномного редактирования:
Простейшими инструментами были ферменты рестрикции, которые способны разрезать ДНК, в области строго специфичных последовательностей. Подобное ограничение сделало невозможным широкое распространение данного подхода в геномном редактировании, однако рестриктазы продолжают активно использоваться в генной инженерии в качестве инструмента молекулярного клонирования, а также для картирования ДНК.
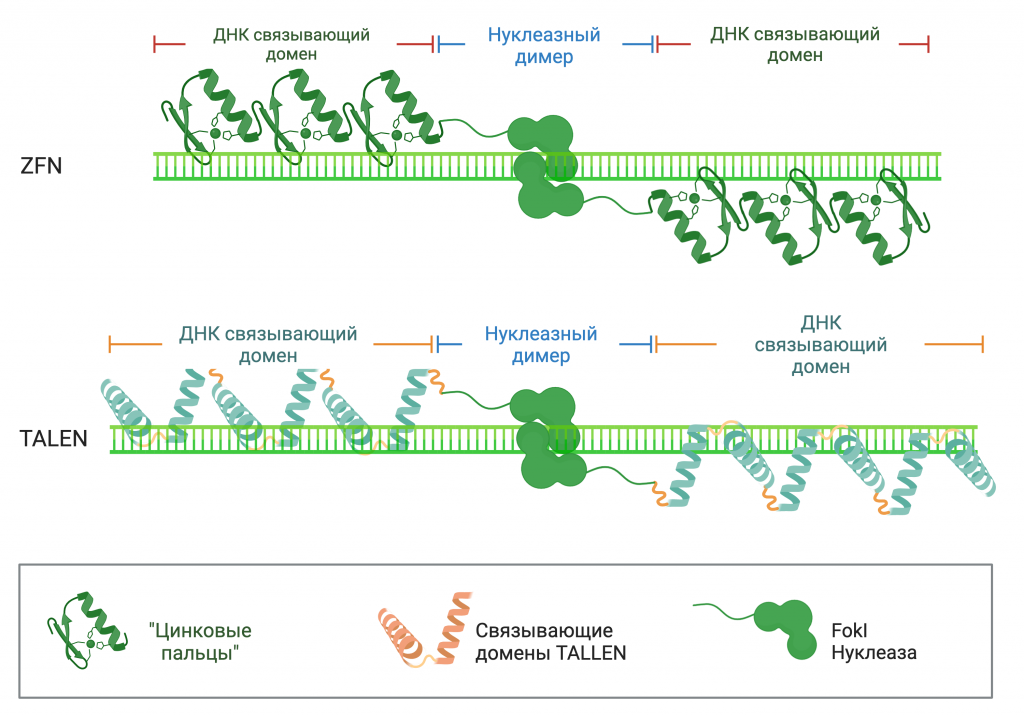
Для формирования направленного редактирования были получены химерные конструкции «Цинковые пальцы» и TALLEN (от англ. Transcription activator-like effector nucleases). С помощью данных систем уже были получены результаты в работах по направленному изменению структуры генома.
Однако процесс создания таких конструкций с белковыми доменами связывания является трудоемким и делает весь процесс подготовки к редактированию. Поэтому появление системы CRISPR/Cas9 способствовало резкому всплеску интереса среди исследователей к данной тематике.
Действительно, новая система геномного редактирования значительно упростила весь процесс модификации ДНК. Ее особенностью является то, что она состоит не только из белковой молекулы – нуклеазы (Cas9), которая формирует двухцепоченые разрывы, но и молекулы направляющей РНК, в составе которой находится специфичная последовательность, комплементарная целевому участку генома.
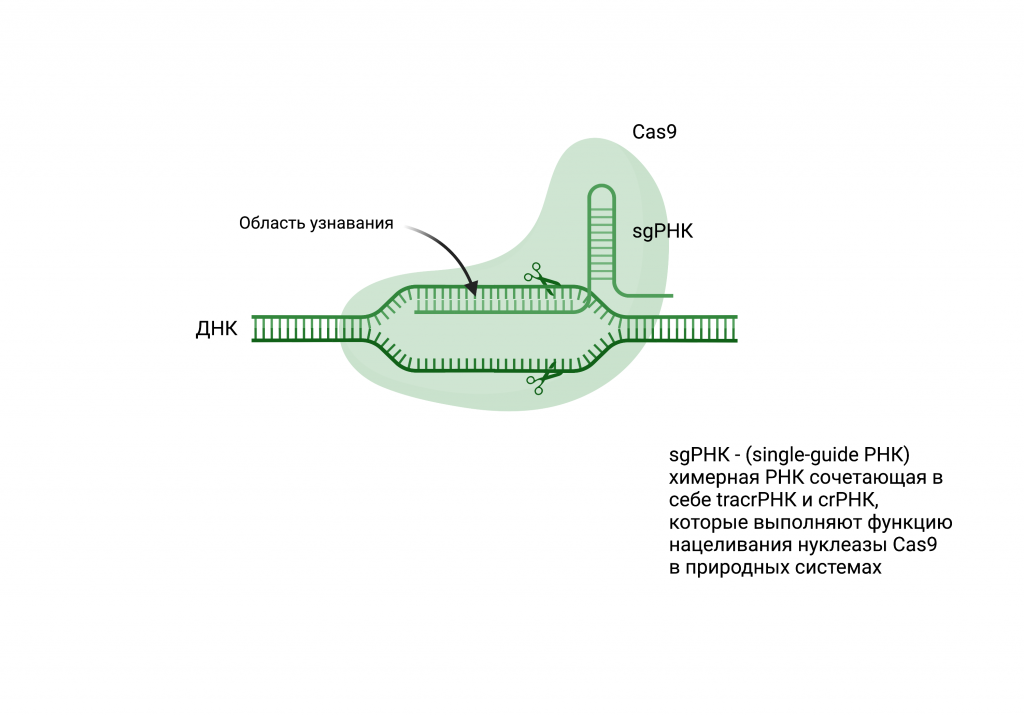
Благодаря тому, что система CRISPR/Cas9 может быть нацелена в любую область генома с помощью специальной направляющей РНК, различные модификации Cas9 получили широкое распространите, так как они позволяют не только внести двухцепопчный разрыв в целевой области ДНК, но и провести различные модификации, что значительно расширяет горизонты применения данной системы в будущем.
Например, использование системы с инактивированным каталитическим центром нуклеазы (dCas9) позволяет регулировать транскрипцию гена-мишени в результате направленного взаимодействия с промотором. Химерный белок, dCas9, объединенный с ферментом деметилазой, позволяют наоборот избирательно активировать экспрессию целевого гена за счет изменения эпигенетического профиля, а соединение Cas9 c флуоресцентной меткой позволяет визуализировать геномные последовательности.
Таким образом, технология CRISPR стремительно развивается и имеет значительный прикладной потенциал для будущих исследований, терапии заболеваний и их диагностики.
3
Геномное редактирование с помощью метода CRISPR/Cas9
Наиболее эффективным и простым методом геномного редактирования является использование система CRISPR/Cas9, которая состоит из двух компонентов направляющей РНК и белка нуклеазы.
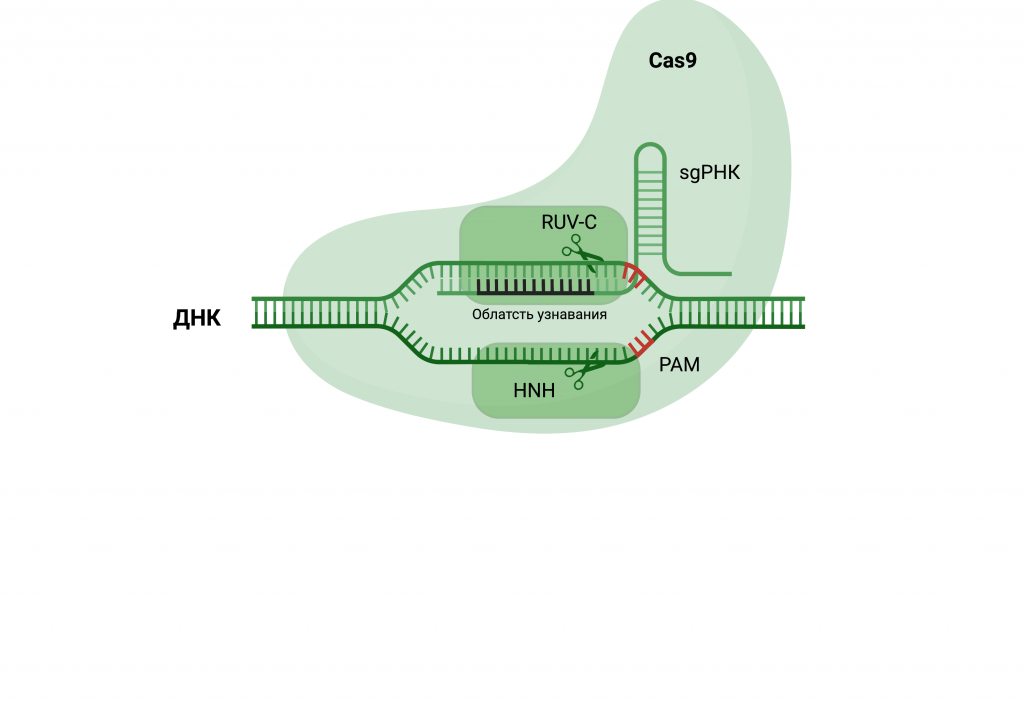
Направляющая РНК имеет область узнавания длинной 18-20 п.о., которая связывается с комплементарной последовательностью ДНК, называемой «протоспейсером». Как оказалось, направляющая РНК способна взаимодействовать с ДНК только в тех случаях, когда там присутствует специальная последовательность – PAM (protospacer adjacent motif). PAM представляет собой короткую последовательность (длиной обычно 2–6 пар оснований), которая следует за участком ДНК, предназначенным для расщепления системой CRISPR.
Канонический PAM представляет собой последовательность 5'-NGG-3', где «N» представляет собой любое азотистое основание, за которым следуют два основания гуанина («G»). Таким образом на первом этапе необходимо правильно подобрать мишень для редактирования и определить последовательность протоспейсера, прилегающего к области PAM в точке вашего интереса.
Последовательность направляющей РНК CRISPR напрямую влияет на эффективность расщепления ДНК-мишени, а также на непреднамеренное связывание и расщепление нецелевой ДНК.
Таким образом, разработка правильной направляющей РНК является важным шагом для успеха всего эксперимента. Кроме того, нужно учитывать что GC состав в sgРНК влияет на ее стабильность и их соотношение должно составлять 40-80%. Для того, чтобы подобрать специфическую последовательность направляющей РНК с минимальными нецелевыми эффектами и максимальной эффективностью можно воспользоваться одним из инструментов: Cas-OFFinder, Synthego Design Tool, CRISPOR
Существует несколько подходов для проведения экспериментов с использованием системы CRISPR/Cas9 – это трансфекция плазмидного вектора, конститутивно экспрессирующего sgРНК и белок Cas9, доставка компонентов геномного редактирования в составе вирусного вектора и трансфекция рибонуклеопротеидного комплекса (РНП).
Для проведения высокоэффективного геномного редактирования в различных клетках рекомендуем использование белка Cas9-NLS с двойным сигналом ядерной локализации вируса SV40 (GE-5030), который направляет нуклеазу непосредственно в область клеточного ядра, где она способна в полной мере реализовать свою функцию.
Для проведения исследований свойств Cas9 in vitro, рекомендуем использовать рекомбинантный вариант белка Cas9 из Streptococcus pyogenes (E-5030). Данный белок позволяет решать задачи в рамках проведения биохимических исследований, установление констант и кинетики реакции с синтетическими субстратами.
Кроме того, белок Cas9 может быть использован для обогащения целевых фрагментов генома с последующим высокопроизводительным секвенированием.
Помимо белка Cas9 для формирования RNP комплекса необходимо получить последовательность для sgРНК. Для этого рекомендуем «Набор для проведения T7-транскрипции in vitro» (T7-tr-20, T7-tr-100).
Принцип действия набора основан на ферментативном синтезе молекул РНК на ДНК-матрице при помощи ДНК-зависимой РНК-полимеразы бактериофага T7. В состав набора входят все необходимые реагенты для получения высокого выхода РНК-транскриптов за минимальное время реакции. Для того, чтобы получить корректную последовательность олигонуклеотида для синтеза направляющей РНК необходимо с 5´- конца добавить последовательность промотора Т7: TTCTAATACGACTCACTATA
После того, как оба компонента RNP комплекса готовы, необходимо выполнить его доставку в клетки наиболее подходящим способом. В настоящий момент существует большое количество различных методов доставки, например: микроинъекция, электропорация, микрофлюидика и многие другие.
Не менее важным этапом в экспериментах с использованием геномного редактирования является анализ полученных данных.
4
СОЗДАНИЕ СИСТЕМ ГЕНОМНОГО РЕДАКТИРОВАНИЯ
Для использования в виде рибонуклеопротеидных комплексов и для исследований свойств белка Cas9 in vitro портфолио компании включает:
- нуклеазу SpCas9 (E-5030)
- нуклеазу SpCas9 с сигналом ядерной локализации SpCas9-NLS (GE-5030, GE-5050)
- набор для синтеза направляющих РНК «Набор для проведения T7-транскрипции in vitro» (T7-tr-20, T7-tr-100).
5
АНАЛИЗ МУТАЦИЙ В ГЕНОМЕ
Далее для анализа мутаций в геноме клеток в каталоге представлен целый комплекс решений, которые позволяют провести все этапы от выделения геномной ДНК до подготовки образцов к транскриптомному и полногеномному секвенированию.Для выделения геномной ДНК из модифицированных клеток рекомендуем использование наборов из линейки D для выделения геномной ДНК (DU-10, DU-50, DU-250). Протокол выделения оптимизирован таким образом, что полученная ДНК может сразу быть использована в ПЦР.
Анализ наличия мутаций можно проводить с использованием метода электрофореза в геле или секвенирования по Сэнгеру. Для этого, на первом этапе необходимо провести амплификацию целевых участков генома клеток. Для простых матриц можно использовать стандартные мастермиксы для ПЦР (MH010-200, MH010-1020), а в случае необходимости наработки длинных или GC-богатых регионов лучше сделать выбор в пользу “Long-Range” (MH040-100, MH040-400).
Для того, чтобы облегчить процесс анализа в геле можно использовать наборы с добавленным красителем для прямого нанесения после ПЦР (MHC010-200, MHC010-1020 и MHC040-100, MHC040-400). Электрофорез в агарозном или полиакриламидном геле позволяет обнаружить значительные делеции или инсерции. Для проведения анализа длины полученных продуктов ПЦР в каталоге Биолабмикс предложен набор ДНК-маркеров от 50 п.н до 10 т.п.н.
Однако для определения коротких делеций или инсерций, а также для выявления нуклеотидных замен необходимо секвенирование целевого фрагмента методом Сэнгера. Для этого полученные продукты из реакции ПЦР можно выделить с помощью Набора для выделения ДНК из реакционных смесей (DR-10, DR-50, DR-250), оценить количество ДНК спектрофотометрически и провести по стандартному протоколу реакцию Сэнгера с последующим анализом с помощью программных пакетов TIDE и ICE для определения мутаций, которые возникли в результате действия системы CRISPR/Cas9.
6
АНАЛИЗ ЭКСПРЕССИИ ГЕНА-МИШЕНИ
Для того чтобы выявить изменения функциональной активности целевого участка ДНК, в область которого была направлена система CRISPR/Cas9, можно оценить уровень мРНК или длинной некодирующей РНК гена-мишени в клетке. Для этого удобно использовать готовые мастермиксы для ОТ-ПЦР в режиме реального времени, предложенные в разделах «Наборы для обратной транскрипции» и «Наборы и смеси для ОТ-ПЦР» (названия с учетом названия разделов в новой версии сайта).Решением, которое обеспечивает качественное и воспроизводимое выделение стабильной суммарной РНК, являются наборы для выделения РНК (RU-10, RU-50, RU-250). Для выделения и анализа коротких форм РНК рекомендуем использование набора для выделения РНК суммарной и микроРНК из клеток и тканей (LRU-100-50)
7
ПОДГОТОВКА ОБРАЗЦОВ ДЛЯ ВЫСОКОПРОИЗВОДИТЕЛЬНОГО NGS-АНАЛИЗА
Для последующего высокопроизводительного анализа из полученных клеточных линий можно выделить суммарную РНК и короткие формы РНК для транскриптомного анализа (рекомендуем для этого Набор для выделения РНК суммарной и микроРНК из клеток и тканей LRU-100-50) и геномную ДНК для полногеномного секвенирования с помощью NGS-платформ (Набор для выделения ДНК/РНК из мазка/соскоба эпителиальных клеток, вирусов, клеток животных и бактерий PN-100, а также набор новой серии D-cells). Таблица комплексного решения
Имя
Каталожный №
Выделений
Цена за шт
Кол-во
Сумма
Имя
Набор для выделения РНК на колонках (модифицированный)
Набор для выделения РНК из культур эукариотических клеток, культур клеток грамотрицательных и грамположительных бактерий, мазков или соскобов эпителиальных клеток, вирусов.
В процессе выделения целостность РНК сохраняется. Возможно выделение до 50 мкг РНК.
Имя
Набор для выделения РНК суммарной и микроРНК из клеток и тканей
Выделение и очистка суммарной РНК и малых форм РНК (до 200 н.т., включая микроРНК) из культур клеток животных и бактерий, тканей животных и растений.
Имя
Набор для выделения геномной ДНК из клеток, тканей и крови
Выделение ДНК из культур клеток животных и бактерий, тканей животных и растений на микроцентрифужных колонках.
Имя
Набор mini для выделения ДНК и РНК из реакционных смесей
Набор предназначен для очистки ДНК и РНК (от 50 до 10000 н.т.) от компонентов реакции, например, от dNTP, ферментов, не
включившихся низкомолекулярных радиоактивных и флуоресцентных меток и др. на микроцентрифужных колонках.
Имя
Каталожный №
Количество мл
Цена за шт
Кол-во
Сумма
Имя
Каталожный №
Количество реакций (50 мкл)
Цена за шт
Кол-во
Сумма
Имя
БиоМастер HS-Taq ПЦР (2×)
2× реакционная смесь, содержащая Taq ДНК-полимеразу с «горячим» стартом, для проведения ПЦР с контролем по конечной точке.
Имя
БиоМастер LR HS-ПЦР (2x)
2х реакционная смесь предназначена для амплификации длинных фрагментов ДНК от 0,2 до 30 т.п.о. с «горячим» стартом. А также для амплификации GC-богатых (>65%) и сложных участков ДНК.
Имя
БиоМастер LR HS-ПЦР-Color (2x)
2х реакционная смесь предназначена для амплификации длинных фрагментов ДНК от 0,2 до 30 т.п.о. с «горячим» стартом, а также для амплификации GC-богатых (>65%) и сложных участков ДНК. Смесь содержит красители, не влияющие на работу полимеразы, и компоненты,
увеличивающие плотность пробы для удобства нанесения на гель.
Имя
БиоМастер HS-Taq ПЦР-Color (2×)
2× реакционная смесь, содержащая Taq ДНК-полимеразу с «горячим» стартом, для проведения стандартной ПЦР, содержит красители для анализа ПЦР-продуктов с помощью электрофореза в геле.
Имя
Набор для проведения T7-транскрипции in vitro
Принцип действия набора основан на ферментативном синтезе молекул РНК на ДНК-матрице при помощи ДНК-зависимой РНК-полимеразы бактериофага T7. В состав набора входят все необходимые реагенты для получения высокого выхода РНК-транскриптов за минимальное время реакции.
Полученная РНК может быть использована для изучения структуры и функций РНК, для систем геномного редактирования в качестве направляющей РНК, для исследования механизмов РНК-интерференции, для трансфекции клеток, для трансляции in vitro и др.
Имя
Каталожный №
Кол-во, пмоль
Цена за шт
Кол-во
Сумма
Имя
Белок-нуклеаза Cas9 - NLS
Белок-нуклеаза Cas9-NLS - рекомбинантная эндонуклеаза Cas9 из Streptococcus pyogenes. Осуществляет сайт-специфический гидролиз фосфодиэфирной связи в двухцепочечной ДНК.
Имя
Каталожный №
Количество, е.а.
Цена за шт
Кол-во
Сумма
Имя
Обратная транскриптаза RNAscribe RT
RNAscribe RT – генетически модифицированная обратная транскриптаза (ревертаза) вируса лейкемии мышей (M-MuLV).
Имя
Каталожный №
Выделений
Цена за шт
Кол-во
Сумма
Имя
Набор для выделения РНК суммарной и микроРНК из клеток и тканей
Выделение и очистка суммарной РНК и малых форм РНК (до 200 н.т., включая микроРНК) из культур клеток животных и бактерий, тканей животных и растений.
Имя
Набор D-cells для выделения ДНК из клеток животных и бактерий
Набор D-cells для выделения ДНК из клеток животных и бактерий.
Имя
Набор для выделения геномной ДНК из клеток, тканей и крови
Выделение ДНК из культур клеток животных и бактерий, тканей животных и растений на микроцентрифужных колонках.
Имя
Набор D-Blood для выделения ДНК из крови
Выделение ДНК из цельной крови, плазмы и сыворотки крови, криопреципитата, лейкоцитов, ликвора на микроцентрифужных колонках.
Имя
Набор mini для выделения ДНК и РНК из реакционных смесей
Набор предназначен для очистки ДНК и РНК (от 50 до 10000 н.т.) от компонентов реакции, например, от dNTP, ферментов, не
включившихся низкомолекулярных радиоактивных и флуоресцентных меток и др. на микроцентрифужных колонках.
Имя
Каталожный №
Количество реакций (50 мкл)
Цена за шт
Кол-во
Сумма
Имя
БиоМастер ОТ-ПЦР–Премиум (2×)
Набор содержит 2× буфер для ОТ-ПЦР–Премиум, содержащий все необходимые компоненты (за исключением ферментов, РНК матрицы и праймеров); смесь ферментов БиоМастер-Премиум-микс, воду, обработанную ДЭПК, ДМСО и буфер для нанесения (6×).
В состав БиоМастер-Премиум-микс входит M-MuLV –RH, HS-Taq ДНК-полимераза и Pfu ДНК-полимераза в оптимальном соотношении для протекания обеих реакций.
Имя
БиоМастер HS-Taq ПЦР (2×)
2× реакционная смесь, содержащая Taq ДНК-полимеразу с «горячим» стартом, для проведения ПЦР с контролем по конечной точке.
Имя
БиоМастер LR HS-ПЦР (2x)
2х реакционная смесь предназначена для амплификации длинных фрагментов ДНК от 0,2 до 30 т.п.о. с «горячим» стартом. А также для амплификации GC-богатых (>65%) и сложных участков ДНК.
Имя
БиоМастер LR HS-ПЦР-Color (2x)
2х реакционная смесь предназначена для амплификации длинных фрагментов ДНК от 0,2 до 30 т.п.о. с «горячим» стартом, а также для амплификации GC-богатых (>65%) и сложных участков ДНК. Смесь содержит красители, не влияющие на работу полимеразы, и компоненты,
увеличивающие плотность пробы для удобства нанесения на гель.
Имя
БиоМастер HS-Taq ПЦР-Спец (2×)
Смесь оптимизирована для проведения эффективной и воспроизводимой ПЦР c “горячим” стартом на сложно-структурированных и/или GC-богатых ДНК-матрицах.
Имя
БиоМастер HS-Taq ПЦР-Color (2×)
2× реакционная смесь, содержащая Taq ДНК-полимеразу с «горячим» стартом, для проведения стандартной ПЦР, содержит красители для анализа ПЦР-продуктов с помощью электрофореза в геле.
Имя
Набор для проведения T7-транскрипции in vitro
Принцип действия набора основан на ферментативном синтезе молекул РНК на ДНК-матрице при помощи ДНК-зависимой РНК-полимеразы бактериофага T7. В состав набора входят все необходимые реагенты для получения высокого выхода РНК-транскриптов за минимальное время реакции.
Полученная РНК может быть использована для изучения структуры и функций РНК, для систем геномного редактирования в качестве направляющей РНК, для исследования механизмов РНК-интерференции, для трансфекции клеток, для трансляции in vitro и др.
Имя
Каталожный №
Кол-во, пмоль
Цена за шт
Кол-во
Сумма
Имя
Белок-нуклеаза Cas9 - NLS
Белок-нуклеаза Cas9-NLS - рекомбинантная эндонуклеаза Cas9 из Streptococcus pyogenes. Осуществляет сайт-специфический гидролиз фосфодиэфирной связи в двухцепочечной ДНК.
Имя
Каталожный №
Количество реакций (25 мкл)
Цена за шт
Кол-во
Сумма
Имя
БиоМастер ОТ-ПЦР SYBR Blue (2×)
Набор предназначен для проведения обратной транскрипции и полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР РВ) одношаговым методом.
Имя
БиоМастер ОТ-ПЦР-РВ (2×)
Набор предназначен для проведения обратной транскрипции и полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР РВ) с флуоресцентными зондами одношаговым методом.
Имя
Каталожный №
Количество реакций (20 мкл)
Цена за шт
Кол-во
Сумма
Имя
Набор реактивов ОТ-M-MuLV-RH с праймерами
Набор реактивов для синтеза первой цепи кДНК с широкого спектра РНК-матриц.
Имя
Каталожный №
Количество (мкг)
Цена за шт
Кол-во
Сумма
Имя
ДНК маркер Step50 plus
ДНК маркер Step 50 plus (13 фрагментов: от 50 до 1500 п.н. с шагом в 50 п.н. от 50 до 400 п.н.), 50 мкг в 500 мкл (0,1 мг/мл), готовый к нанесению.
Имя
ДНК маркер Step 100
ДНК маркер Step 100 (10 фрагментов: 100, 200, 300, 400, 500, 600, 700, 800, 900 и 1000 п.н.), 50 мкг в 500 мкл (0,1 мг/мл), готовый к нанесению.
Имя
ДНК маркер Step 100 Long
ДНК маркер Step 100 Long (14 фрагментов: 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1200, 1500, 2000 и 3000 п.н.), 50 мкг в 500 мкл (0,1 мг/мл), готовый к нанесению.
