Изотермическая амплификация
Изотермической амплификацией называют процесс образования дополнительных копий определенных участков ДНК или РНК, протекающий при постоянной температуре. За счет использования особого типа полимераз, с вытесняющей активностью, в процессе изотермической амплификации отсутствует необходимость в денатурации цепей ДНК, а следовательно, и в циклических изменениях температуры. В большинстве случаев температурный оптимум подобных реакций находится в диапазоне от 37°C до 65°C.
1
Петлевая изотермическая амплификация (LAMP)
Одним из наиболее распространенных типов изотермической амплификации является петлевая изотермическая амплификация (LAMP). В данном подходе используется набор из четырех или шести праймеров для распознавания нескольких областей на целевой последовательности ДНК, при этом амплификация происходит в результате последовательного вытеснения полимеразой цепей ДНК.
Также к примерам изотермической амплификации можно отнести амплификацию на основе последовательности нуклеиновых кислот (NASBA), Геликаза-зависимую амплификацию (HDA) и амплификацию по типу катающегося кольца (RCA).
К основным преимуществам изотермической амплификации можно отнести высокую скорость протекания реакции (20–40 минут), а также возможность проведения эксперимента с помощью простой водяной бани или нагревательного блока, без использования дополнительного дорогостоящего оборудования. За счет этого изотермическая амплификация становится все более перспективным методом, как для полевых исследований в области сельского хозяйства и экологии, так и в лабораторной диагностике.
2
Подготовка к LAMP
Перед проведением петлевой изотермической амплификации необходимо одним из наиболее подходящих методов выделить из исследуемых образцов ДНК или РНК (Рис.1). В полевых условиях наиболее подходящим методом является использование магнитных частиц, так как в данном случае для выделения НК не требуется никакого дополнительного оборудования, за исключением магнитного штатива. Для выделения РНК и ДНК в полевых условиях рекомендуем использовать набор на магнитных частицах (NAmagp) от компании «Биолабмикс». В то время, как для работы в лабораторных условиях удобнее применять колоночные методы очистки. Для выделения РНК рекомендуем использование модифицированного набора RUplus, с повышенным выходом, а для выделения ДНК, предлагаем воспользоваться наиболее подходящим набором из нашей линейки D. В настоящий момент мы предлагаем готовые наборы для выделения из соскобов, тканей растений и животных, различных типов клеток, в том числе и бактериальных (D-Swabs/D-Tissue/D-Blood/D-cells).
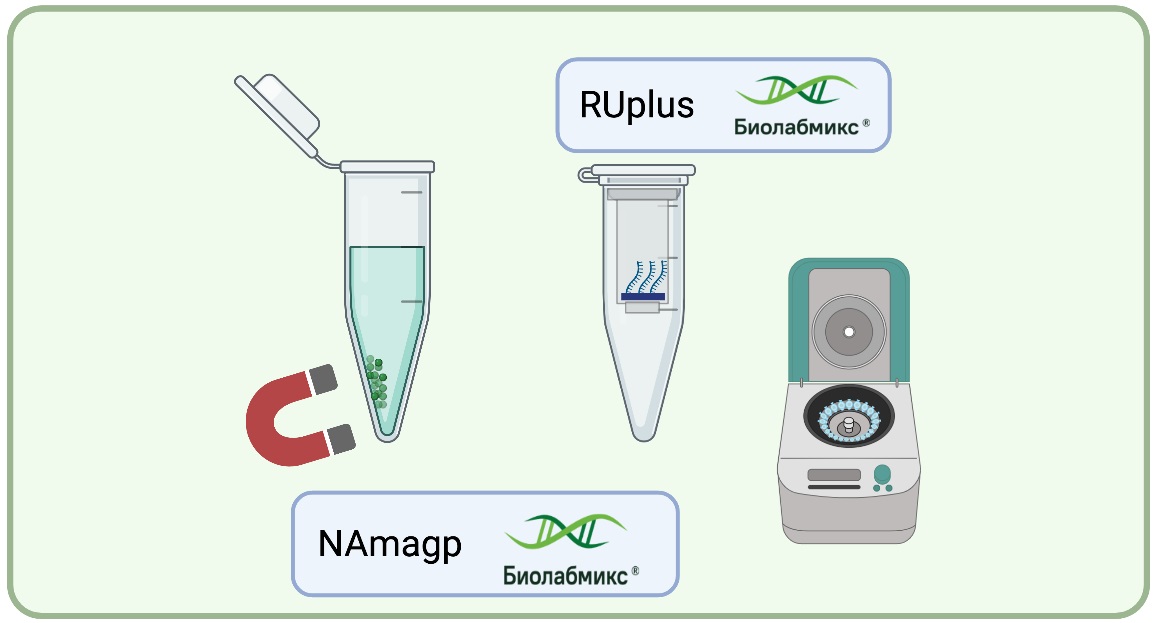
Рис.1 Методы выделения НК для последующей реакции LAMP
При работе с РНК, возможен еще один дополнительный этап подготовки – проведение предварительной обратной транскрипции (Рис.2). Выполнение данной процедуры является целесообразным, при условии длительного хранения образцов, так как форма кДНК является более стабильной чем РНК. Для проведения обратной транскрипции рекомендуем использование обратной транскриптазы M-MuLV (R03) или высокоспецифичной ревертазы RNAscribe (R04) от компании «Биолабмикс».
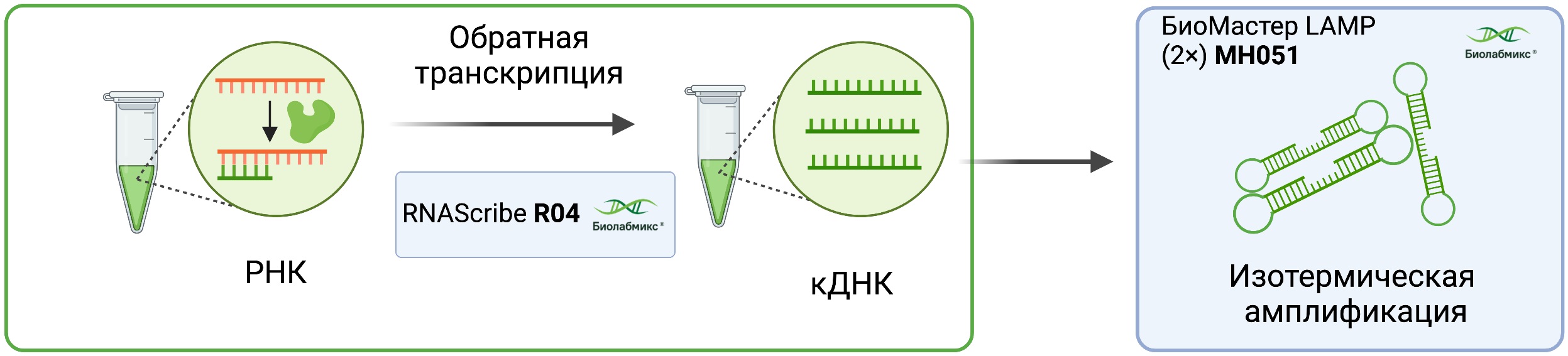
Рис.2 Предварительная реакция обратной транскрипции для последующей реакции LAMP
3
Подбор праймеров
Ключевым и наиболее сложным этапом в осуществлении изотермической петлевой амплификации является подбор группы праймеров. В зависимости от задачи и протокола исследования используют 2 или 3 пары специфичных праймеров.
Для визуализации процесса изотермической амплификации области ДНК, с которыми происходит связывание внутренних и внешних праймеров промаркированы соответствующим цветом и индексом (F1, …, B3c), где c – обозначает комплементарность (Рис. 3).
Внутренние праймеры содержат свисающие участки (оверхенги), которые представляют собой последовательности комплементарные вновь синтезированным последовательностям. Например, если после связывания праймера F2, синтезируется участок F1, то оверхенг внутреннего праймера должен содержать область комплементарную последовательности F1. Таким образом, инициирующий праймер будет состоять из двух фрагментов 5’-F1c-F2-3’. Внешние праймеры подбираются таким образом, чтобы их взаимодействие проходило с участком, предшествующим области связывания с внутренним праймером. Такое расположение необходимо для успешного вытеснения вновь синтезированных фрагментов амплификации. Еще одна пара праймеров, связывается с петлевой последовательностью, которая формируется при взаимодействии концевых участков с комплементарными последовательностями внутри ампликона. Использование петлевых праймеров является необязательным, тем не менее их присутствие в реакции способствует значительному повышению эффективности и скорости реакции.
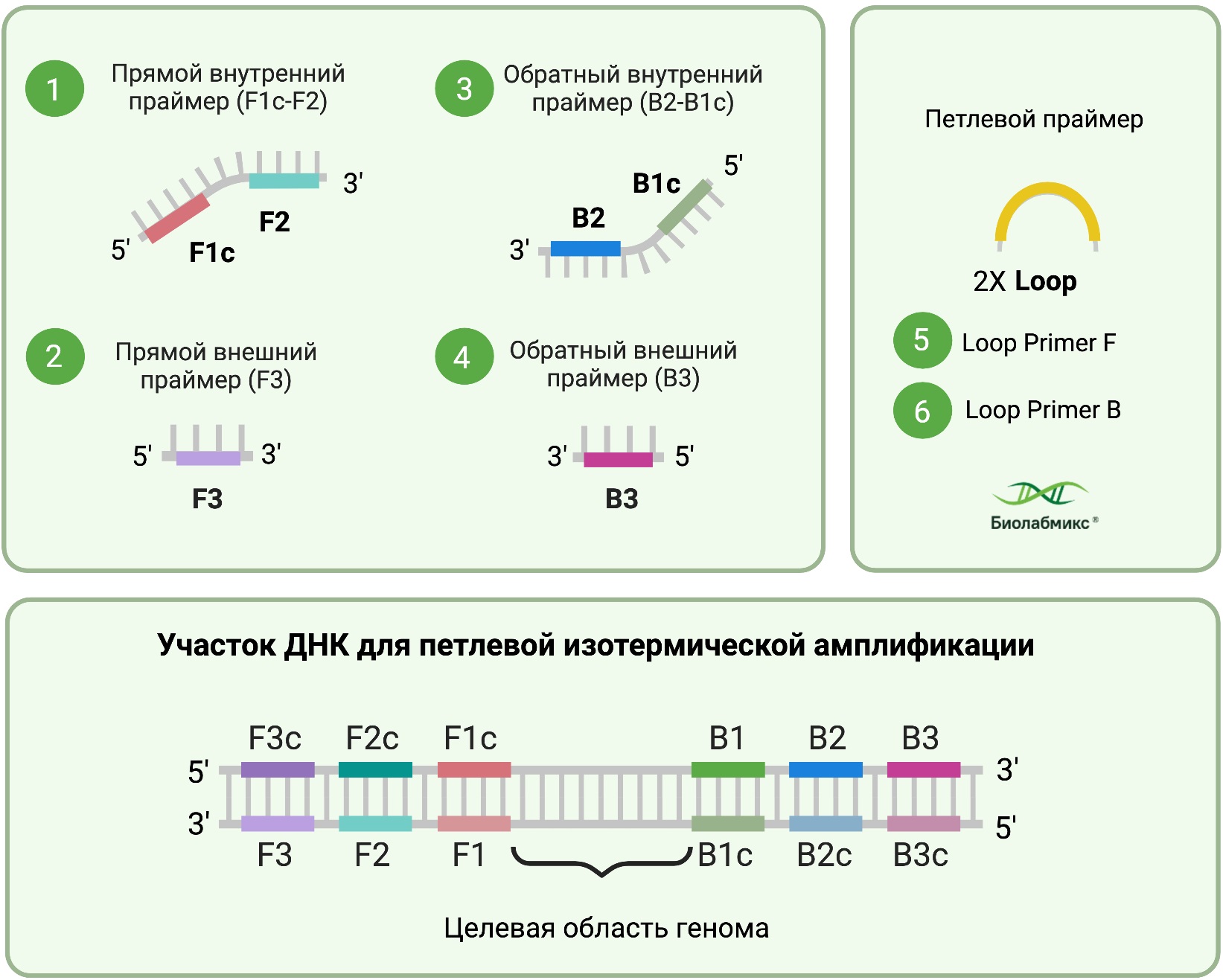
Рис.3 Праймеры для проведения петлевой изотермической амплификации
Дизайн праймера может быть выполнен с помощью нескольких программ, таких как PrimerExplorer, MorphoCatcher (http://morphocatcher.ru).
Разработка тест-систем на основе LAMP предполагает не только дизайн праймеров, но и определение их оптимальных концентраций. Кроме того, необходимо подобрать концентрацию ионов магния, температуру реакции, подходящий буфер. Для обеспечения наилучшего результата рекомендуем использовать готовые смеси для LAMP БиоМастер от компании «Биолабмикс», в которых необходимые компоненты находятся в оптимизированном соотношении для большинства реакций.
4
Амплификация
BST ДНК-полимераза — это высокоточная ДНК-полимераза, полученная из бактерии Bacillus stearothermophilus. Она широко используется в молекулярно-биологических исследованиях для различных методов амплификации благодаря своей точности и способности работать при высоких температурах. Большой фрагмент (LF) представляет собой усеченную форму полимеразы BST. Он также обладает высокой процессивностью и способностью к вытеснению нитей ДНК, что позволяет амплифицировать длинные и сложные последовательности с высокой точностью и при постоянной температуре. Для проведения реакции петлевой изотермической амплификации рекомендуем использовать двухкратный БиоМастер LAMP (MH051) от компании «Биолабмикс», в состав которого входит Bst ДНК полимераза, большой фрагмент (E-10002).
Процесс амплификации начинается с денатурации и инвазии внутреннего праймера, который связывается с комплементарной областью одной из цепей ДНК. За счет вытесняющей активности BST полимеразы в процессе наращивания праймера, параллельно происходит разрыв впередиидущих водородных связей и разделение нитей (Рис.4.2). После того как первый комплементарный участок оказывается полностью синтезирован с целевым участком матрицы связывается внешний праймер (Рис.4.4). Его основная задача заключается в инициации процесса диссоциации последовательности ДНК, только что полученной при удлинении внутреннего праймера. Затем после осуществления первых циклов амплификации, за счет наличия комплементарных участков формируются гантелевидные продукты амплификации (Рис.4.7). Полученные ампликоны содержат петлевые структуры на концевых участках, которые выполняют несколько важных функций. Во-первых, они повышают специфичность праймеров, увеличивая вероятность того, что они будут связываться только с целевой последовательностью. Во-вторых, они позволяют инициировать циклический процесс вытеснения вновь синтезированных участков ДНК. Кроме того, петлевые области способствуют высокой чувствительности LAMP-анализов, облегчая амплификацию мишеней с низким числом копий. Кроме того, для повышения эффективности и скорости реакции рекомендуется использовать дополнительную пару петлевых праймеров. Финальные продукты петлевой амплификации зачастую представляют собой группу различных конкатомеров (Рис. 5).

Рис.4 Механизм петлевой изотермической амплификации
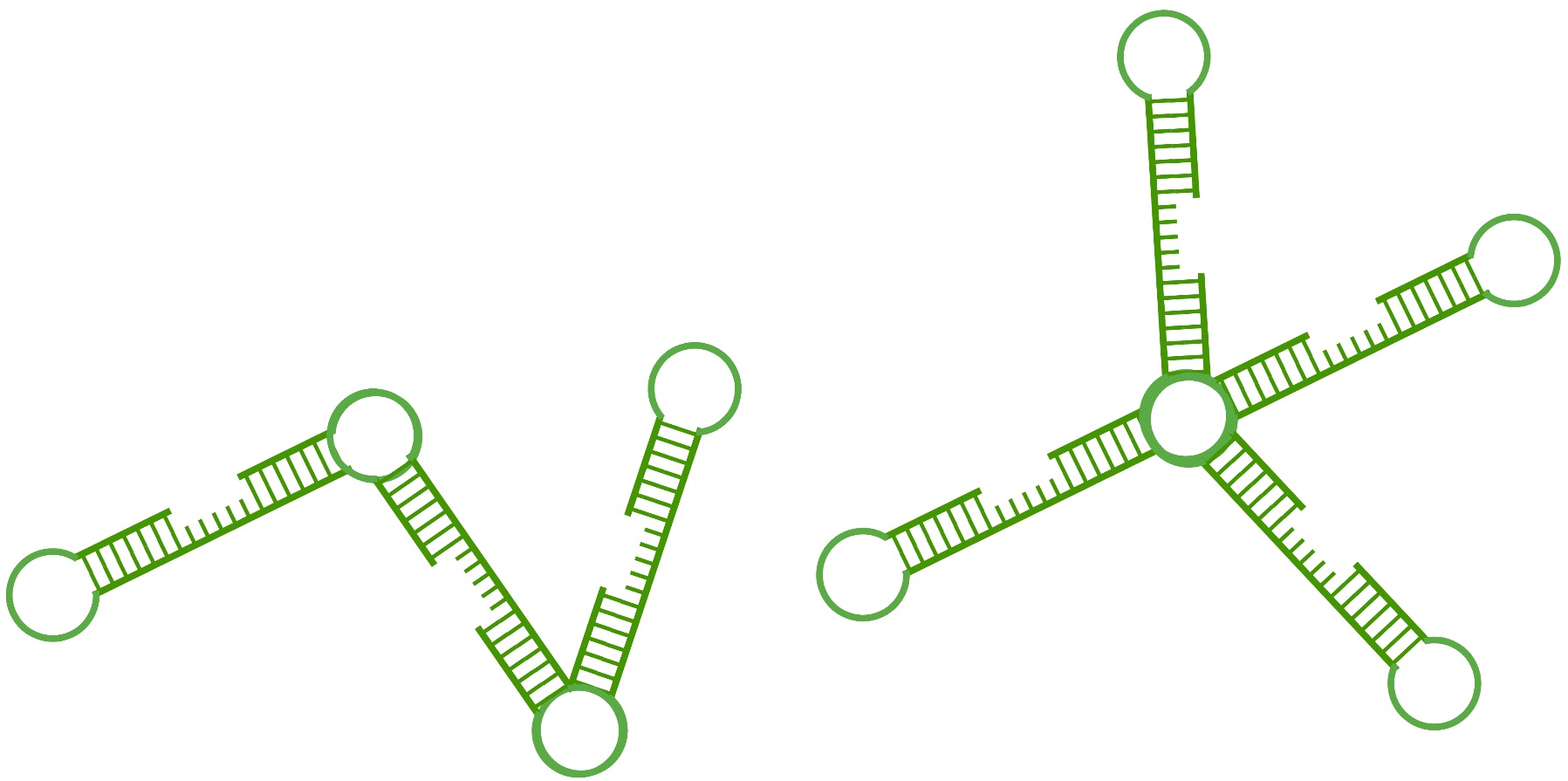
Рис.5 Продукты петлевой изотермической амплификации
5
Детекция
Для обнаружения продуктов петлевой изотермической амплификации выделяют несколько различных подходов. Для качественного анализа могут быть использованы такие методы как: оценка замутненности раствора пирофосфатом, использование гель-электрофореза и колориметрия.
- Помутнение раствора: Одним из самых простых и широко используемых методов обнаружения продуктов LAMP является измерение степени помутнения реакционной смеси. По мере протекания реакции LAMP и амплификации ДНК мутность реакционной смеси увеличивается из-за образования нерастворимого пирофосфата магния (Рис. 6А). Оценку замутнённости можно измерить спектрофотометрически.
- Гель-электрофорез: Другой распространенный метод обнаружения продуктов LAMP заключается в проведении реакционной смеси в агарозном геле и визуализации амплифицированных фрагментов ДНК с помощью окрашивания бромистым этидием или другими ДНК-специфическими красителями (Рис. 6Б). Этот метод может дать информацию о размере и количестве амплифицированных продуктов. Для проведения гель-электрофореза рекомендуем использование 50х Буфер для электрофореза нуклеиновых кислот (BE-DNA) и Линейку ДНК маркеров от компании «Биолабмикс».
- Колориметрическое обнаружение: Продукты LAMP можно также обнаружить с помощью колориметрических индикаторов, таких как феноловый красный или гидроксинафтоловый синий, которые изменяют цвет в присутствии кислоты, образующейся в ходе реакции LAMP (Рис. 6Б). Этот метод может быть визуализирован невооруженным глазом и полезен для полевых применений, где нет доступного оборудования.
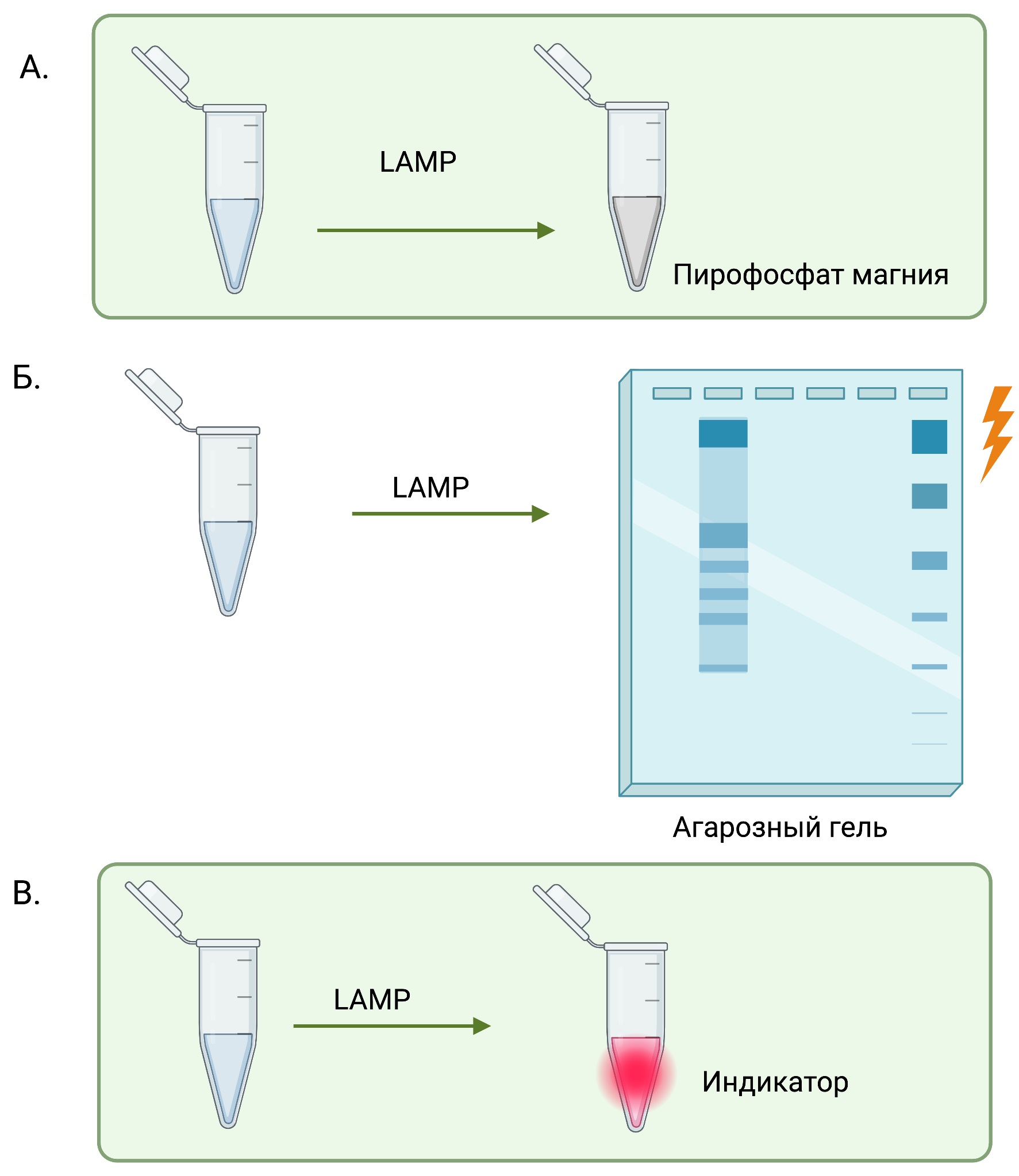
Рис. 6 Методы качественного анализа результатов петлевой изотермической амплификации
Продукты LAMP также могут быть обнаружены с помощью флуоресцентных красителей, таких как SYBR Green, который связывается с двухцепочечной ДНК и излучает флуоресцентный сигнал под воздействием света (Рис. 7). Приборы для ПЦР в режиме реального времени способны измерять интенсивность флуоресценции во время реакции, что позволяет провести количественную оценку амплифицированной ДНК. Для высокоточного количественного анализа продуктов изотермической амплификации рекомендуем использование БиоМастера LAMP SYBR (2×) с интеркалирующим красителем (MH050) от компании «Биолабмикс».
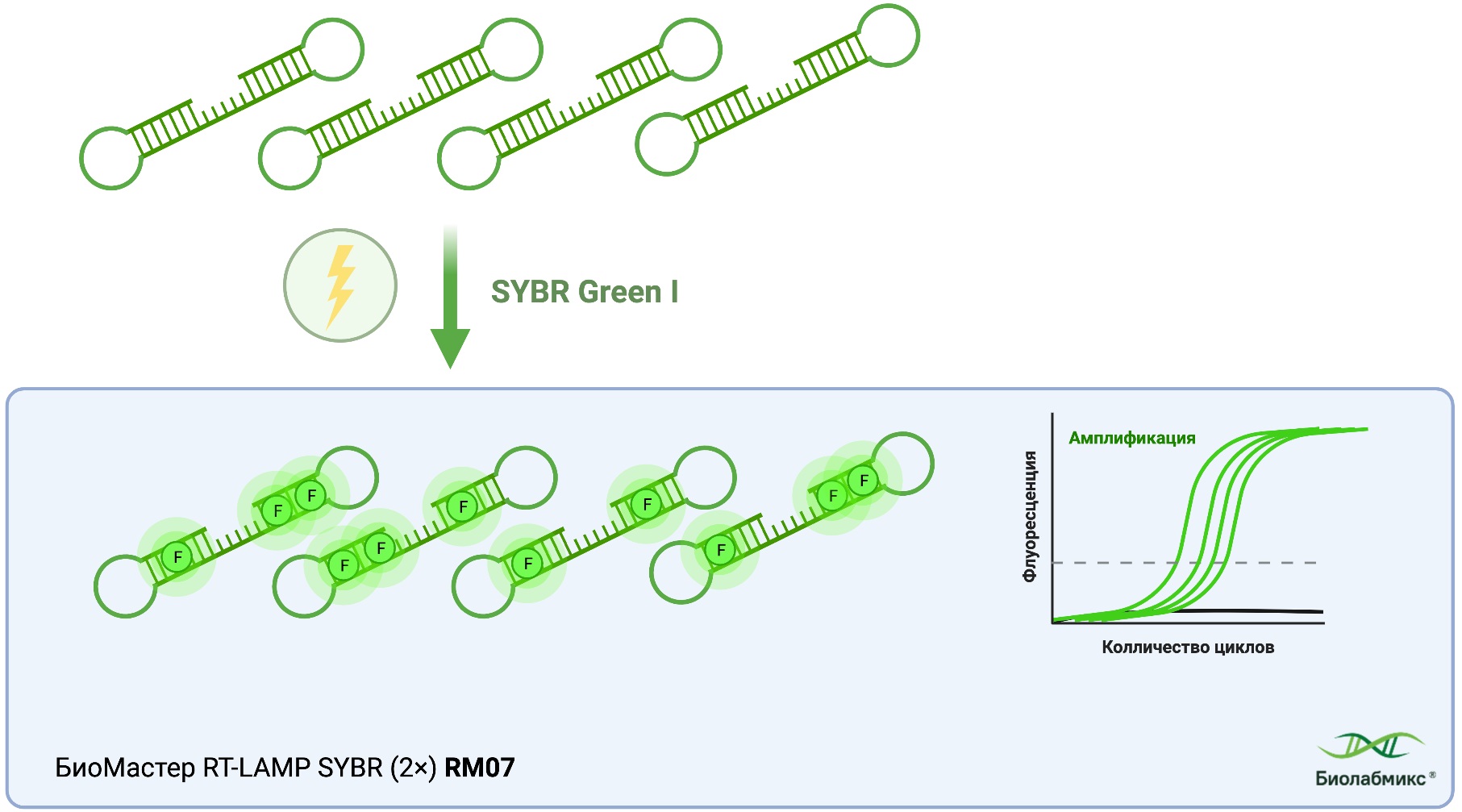
Рис.7 Детекция продуктов LAMP в режиме реального времени с помощью интеркалирующего красителя
Для детекции в режиме реального времени также используются флуоресцентно-меченные зонды (Рис. 8). Данный подход позволяет обнаружить нескольких целевых объектов в одной реакции. Для проведения петлевой изотермической амплификации в режиме реального времени с флуоресцентными зондами рекомендуем использование БиоМастера LAMP (2×) от компании «Биолабмикс» (МН051).
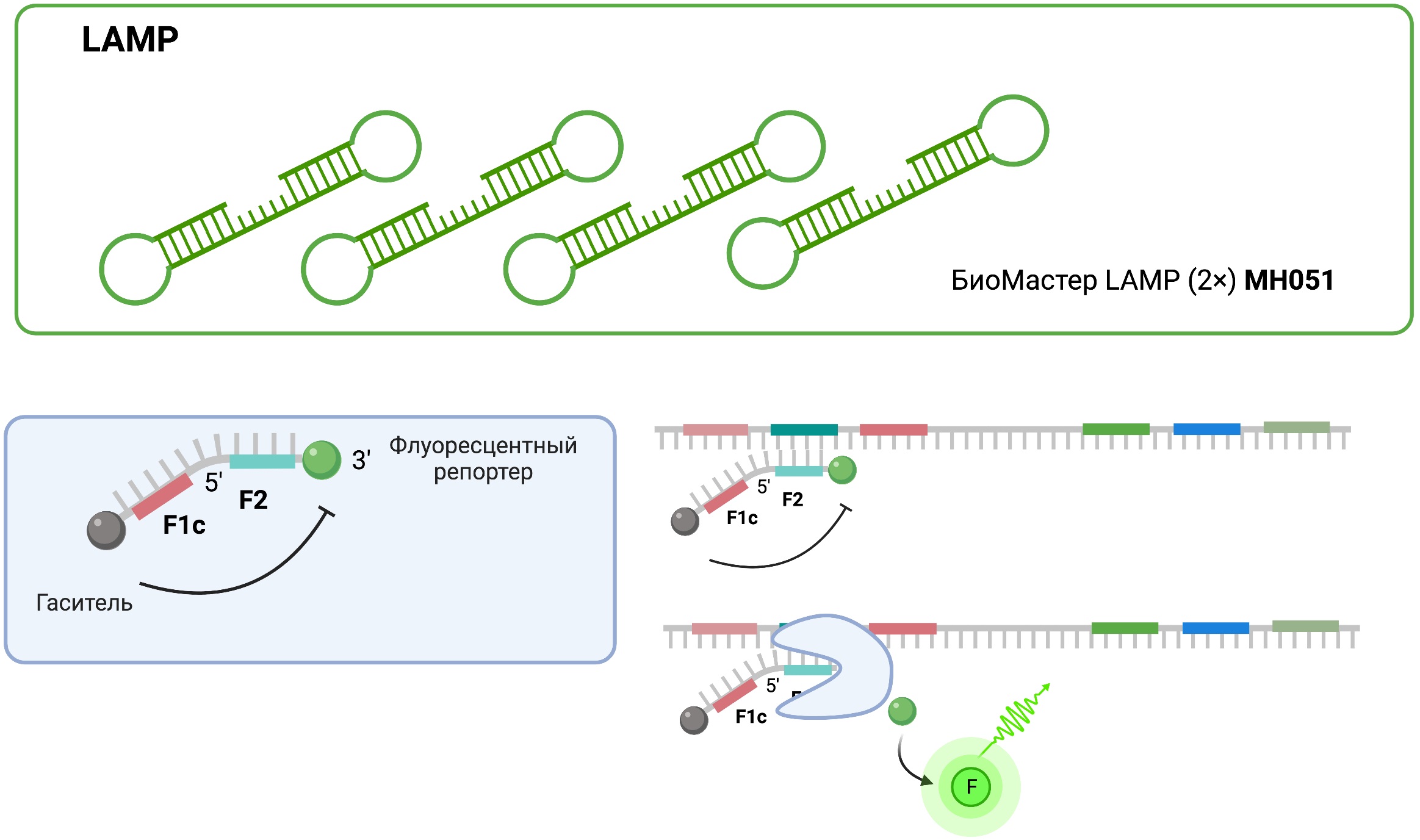
Рис. 8 Детекция продуктов петлевой изотермической амплификации с помощью флуоресцентномеченных праймеров
6
RT-LAMP
Как было показано ранее для проведения петлевой изотермической амплификации в случае работы с молекулами РНК необходимо провести обратную транскрипцию. При этом ОТ и LAMP могут быть разделены на отдельные этапы или же наоборот проходить одновременно в одной пробирке. Для проведения одностадийной реакции в режиме реального времени с интеркалирующим красителем рекомендуем использовать БиоМастер RT-LAMP SYBR (2×), для детекции по конечной точке или для анализа с флуоресцентными зондами предлагаем использовать БиоМастер RT-LAMP (RM08) от компании «Биолабмикс» (Рис.9).
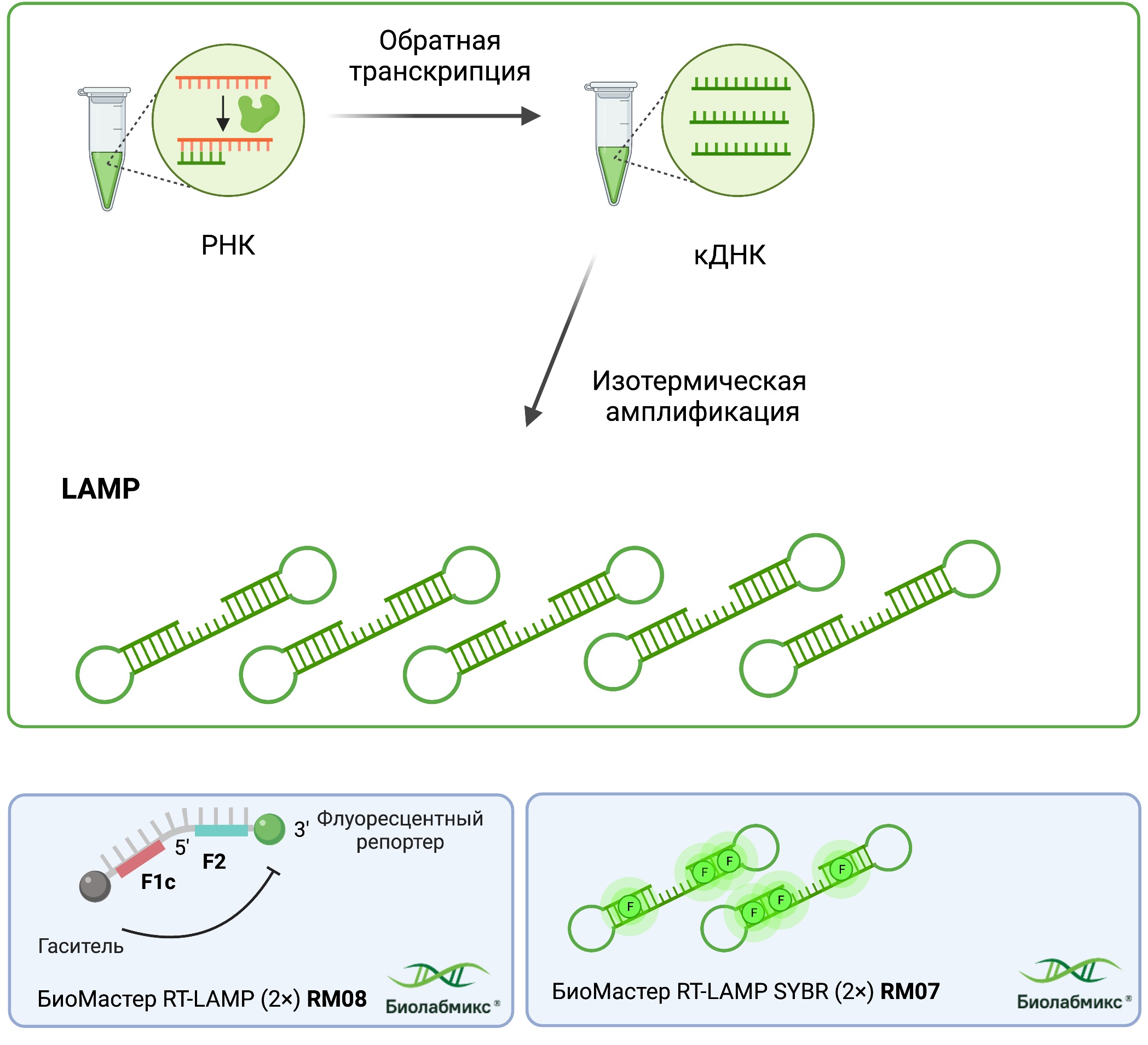
Рис. 9 Схема реакции одностадийной ОТ-LAMP
7
Сравнение LAMP и ПЦР
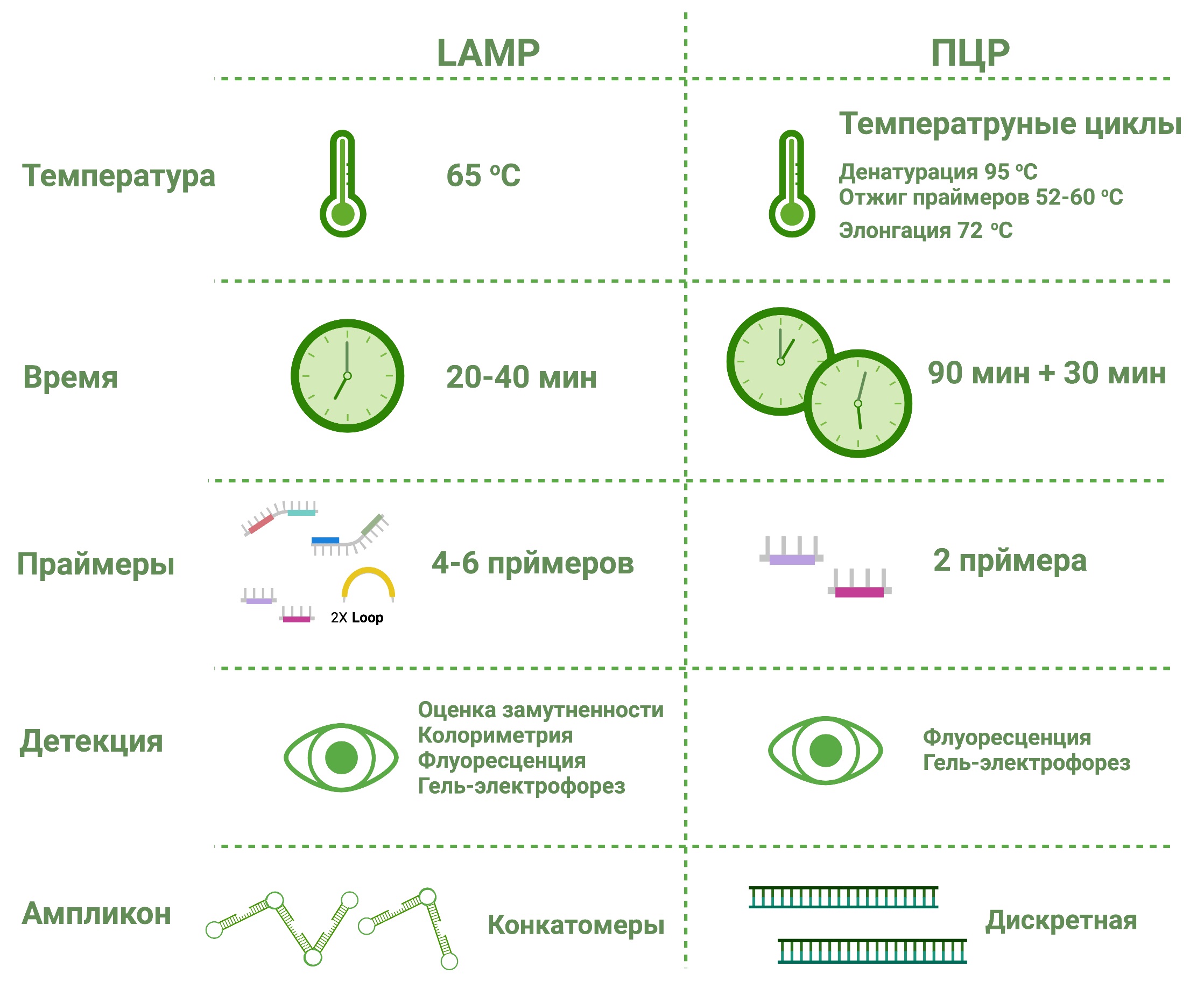
Рис. 10 Таблица сравнения ПЦР и петлевой изотермической амплификации
По сравнению с ПЦР изотермическая амплификация является более простой и быстрой методикой, однако при этом она требует использования специфичной ДНК-полимеразы и от четырех до шести праймеров. LAMP позволяет амплифицировать более длинные последовательности при постоянной температуре, около 60-65°C, что значительно снижает затраты на проведение анализа. Также образование продукта LAMP можно определить визуально с помощью колориметрического индикатора или оценив помутнение раствора. В то же время ПЦР является также распространённым подходом для исследований и диагностики. Кроме того, все методики и протоколы проведения ПЦР являются хорошо оптимизированными и требуют только одну пару праймеров.
Таблица комплексного решения
Имя
Каталожный №
Количество, е.а.
Цена за шт
Кол-во
Сумма
Имя
Обратная транскриптаза RNAscribe RT
RNAscribe RT – генетически модифицированная обратная транскриптаза (ревертаза) вируса лейкемии мышей (M-MuLV).
Имя
Обратная транскриптаза M-MuLV
Повышение доли полноразмерной кДНК за счёт удаления РНКаза Н - подобной активности.
Имя
Bst ДНК полимераза, большой фрагмент
Большой фрагмент ДНК полимеразы Bacillus stearothermophilus. Фермент является высокопроцессивным и катализирует синтез ДНК в направлении 5’-3’.
Имя
Каталожный №
Выделений
Цена за шт
Кол-во
Сумма
Имя
Набор для выделения РНК на колонках (модифицированный)
Набор для выделения РНК из культур эукариотических клеток, культур клеток грамотрицательных и грамположительных бактерий, мазков или соскобов эпителиальных клеток, вирусов.
В процессе выделения целостность РНК сохраняется. Возможно выделение до 50 мкг РНК.
Имя
Набор для выделения РНК на магнитных частицах
Набор для выделения РНК из культур клеток животных и бактерий, мазков/соскобов, вирусов на магнитных частицах. Ручной и автоматический способы выделения. Auto-Pure96 (Allsheng) и KingFisher Flex (ThermoScientific).
Имя
Набор D-cells для выделения ДНК из клеток животных и бактерий
Набор D-cells для выделения ДНК из клеток животных и бактерий.
Имя
Набор D-Blood для выделения ДНК из крови
Выделение ДНК из цельной крови, плазмы и сыворотки крови, криопреципитата, лейкоцитов, ликвора на микроцентрифужных колонках.
Имя
Набор D-Plants для выделения ДНК из растений
Набор предназначен для выделения и очистки ДНК на колонках из следующих образцов:
1. Листья, хвоя, тычинки, зелёные части растений
2. Корни, стебли, кора
3. Плоды, ягоды, семена
4. Мхи, лишайники, грибы
5. Одноклеточные водоросли
Имя
Набор для выделения ДНК из крови на магнитных частицах
Набор MagBlood предназначен для выделения и очистки ДНК из образцов цельной крови, взятой в одноразовые пробирки со следующими антикоагулянтами:
К3EDTA, цитрат натрия 3.2% и 3.8%, CPDA, гепарином натрия
Имя
Каталожный №
Количество мл
Цена за шт
Кол-во
Сумма
Имя
10× LAMP-буфер
10× LAMP-буфер оптимизирован для проведения петлевой изотермической амплификации (LAMP). Буфер химически стабилен, инертен и не меняет оптимальной температуры отжига праймеров или характеристики плавления матрицы.
Имя
Каталожный №
Количество реакций (25 мкл)
Цена за шт
Кол-во
Сумма
Имя
БиоМастер LAMP (2×)
2× реакционная смесь БиоМастер LAMP (2×) предназначена для проведения петлевой изотермической амплификации (LAMP) с последующим контролем прохождения реакции в геле.
Имя
БиоМастер LAMP SYBR (2×)
2× реакционная смесь БиоМастер LAMP SYBR (2×) предназначена для проведения петлевой изотермической амплификации (LAMP) в режиме реального времени с использованием флуоресцентного красителя SYBR Green I.
Имя
БиоМастер RT-LAMP (2×)
Набор предназначен для проведения обратной транскрипции (RT) и петлевой изотермической амплификации (LAMP) в одной пробирке.
Имя
БиоМастер RT-LAMP SYBR (2×)
Набор предназначен для проведения обратной транскрипции (RT) и петлевой изотермической амплификации (LAMP) в
одной пробирке, в режиме реального времени с использованием флуоресцентного красителя SYBR Green I.
Имя
Каталожный №
Количество реакций
Цена за шт
Кол-во
Сумма
Имя
БиоМастер LAMP-Color(2×)
2× реакционная смесь БиоМастер LAMP-Color (2×) оптимизирована для проведения эффективной и воспроизводимой LAMP с образцами геномной, плазмидной и вирусной ДНК.
В ходе амплификации реакционные смеси меняют свой цвет с красного на желтый за 15-60 мин.
Имя
БиоМастер RT-LAMP-Color (2×)
Набор предназначен для проведения колориметрической обратной транскрипции (RT) и петлевой изотермической амплификации (LAMP) в одной пробирке.
В ходе амплификации реакционные смеси меняют свой цвет с красного на желтый за 15-60 мин, в зависимости от концентрации матрицы. Набор позволяет проводить эффективную RT-LAMP со сложных и GC-богатых матриц.
Имя
Каталожный №
Количество (мкг)
Цена за шт
Кол-во
Сумма
Имя
ДНК маркер Start250
ДНК маркер Start250 состоит из 8 фрагментов ДНК: 250, 500, 750, 1000, 1500, 2000, 2500, 3000 п.н. Фрагмент длиной 1000 п.н. имеет удвоенную концентрацию, что облегчает его идентификацию в геле.
Имя
ДНК маркер Step50 plus
ДНК маркер Step 50 plus (13 фрагментов: от 50 до 1500 п.н. с шагом в 50 п.н. от 50 до 400 п.н.), 50 мкг в 500 мкл (0,1 мг/мл), готовый к нанесению.
Имя
ДНК маркер Step 100
ДНК маркер Step 100 (10 фрагментов: 100, 200, 300, 400, 500, 600, 700, 800, 900 и 1000 п.н.), 50 мкг в 500 мкл (0,1 мг/мл), готовый к нанесению.
Имя
ДНК маркер Step 100 Long
ДНК маркер Step 100 Long (14 фрагментов: 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1200, 1500, 2000 и 3000 п.н.), 50 мкг в 500 мкл (0,1 мг/мл), готовый к нанесению.
Имя
Каталожный №
Количество, е.а.
Цена за шт
Кол-во
Сумма
Имя
Обратная транскриптаза RNAscribe RT
RNAscribe RT – генетически модифицированная обратная транскриптаза (ревертаза) вируса лейкемии мышей (M-MuLV).
Имя
Обратная транскриптаза M-MuLV
Повышение доли полноразмерной кДНК за счёт удаления РНКаза Н - подобной активности.
Имя
Bst ДНК полимераза, большой фрагмент
Большой фрагмент ДНК полимеразы Bacillus stearothermophilus. Фермент является высокопроцессивным и катализирует синтез ДНК в направлении 5’-3’.
Имя
Обратная транскриптаза M-MuLV –RH
M-MuLV –RH – генетически модифицированная обратная транскриптаза (ревертаза) вируса лейкемии мышей (M-MuLV). Фермент проявляет РНК- и ДНК-зависимую полимеразную активность, но лишен активности РНКазы Н. M-MuLV –RH проявляет оптимальную активность при 42 °С (активна до 50 °С). В набор также входит 5 × ОТ-буфер-mix, который содержит все необходимые компоненты для работы ревертазы, кроме праймеров и РНК-матрицы.
Имя
Каталожный №
Выделений
Цена за шт
Кол-во
Сумма
Имя
Набор для выделения РНК на колонках (модифицированный)
Набор для выделения РНК из культур эукариотических клеток, культур клеток грамотрицательных и грамположительных бактерий, мазков или соскобов эпителиальных клеток, вирусов.
В процессе выделения целостность РНК сохраняется. Возможно выделение до 50 мкг РНК.
Имя
Набор для выделения РНК на магнитных частицах
Набор для выделения РНК из культур клеток животных и бактерий, мазков/соскобов, вирусов на магнитных частицах. Ручной и автоматический способы выделения. Auto-Pure96 (Allsheng) и KingFisher Flex (ThermoScientific).
Имя
Набор D-cells для выделения ДНК из клеток животных и бактерий
Набор D-cells для выделения ДНК из клеток животных и бактерий.
Имя
Набор D-Blood для выделения ДНК из крови
Выделение ДНК из цельной крови, плазмы и сыворотки крови, криопреципитата, лейкоцитов, ликвора на микроцентрифужных колонках.
Имя
Каталожный №
Количество мл
Цена за шт
Кол-во
Сумма
Имя
10× LAMP-буфер
10× LAMP-буфер оптимизирован для проведения петлевой изотермической амплификации (LAMP). Буфер химически стабилен, инертен и не меняет оптимальной температуры отжига праймеров или характеристики плавления матрицы.
Имя
Каталожный №
Количество реакций (25 мкл)
Цена за шт
Кол-во
Сумма
Имя
БиоМастер LAMP (2×)
2× реакционная смесь БиоМастер LAMP (2×) предназначена для проведения петлевой изотермической амплификации (LAMP) с последующим контролем прохождения реакции в геле.
Имя
БиоМастер LAMP SYBR (2×)
2× реакционная смесь БиоМастер LAMP SYBR (2×) предназначена для проведения петлевой изотермической амплификации (LAMP) в режиме реального времени с использованием флуоресцентного красителя SYBR Green I.
Имя
БиоМастер RT-LAMP (2×)
Набор предназначен для проведения обратной транскрипции (RT) и петлевой изотермической амплификации (LAMP) в одной пробирке.
Имя
БиоМастер RT-LAMP SYBR (2×)
Набор предназначен для проведения обратной транскрипции (RT) и петлевой изотермической амплификации (LAMP) в
одной пробирке, в режиме реального времени с использованием флуоресцентного красителя SYBR Green I.
Имя
Каталожный №
Количество (мкг)
Цена за шт
Кол-во
Сумма
Имя
ДНК маркер Step50 plus
ДНК маркер Step 50 plus (13 фрагментов: от 50 до 1500 п.н. с шагом в 50 п.н. от 50 до 400 п.н.), 50 мкг в 500 мкл (0,1 мг/мл), готовый к нанесению.
Имя
ДНК маркер Step 100
ДНК маркер Step 100 (10 фрагментов: 100, 200, 300, 400, 500, 600, 700, 800, 900 и 1000 п.н.), 50 мкг в 500 мкл (0,1 мг/мл), готовый к нанесению.
Имя
ДНК маркер Step 100 Long
ДНК маркер Step 100 Long (14 фрагментов: 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1200, 1500, 2000 и 3000 п.н.), 50 мкг в 500 мкл (0,1 мг/мл), готовый к нанесению.
